Nome original do viés: Reporting Bias
Tradutor: Victor Alexandre dos Santos Valsecchi, Lara Faria Souza Dias, Rachel Riera
É a distorção sistemática que surge da divulgação seletiva ou retenção de informações pelas partes envolvidas no projeto, condução, análise ou divulgação do estudo ou resultados de pesquisa.
Introdução
Viés de relato é um termo abrangente que inclui diferentes tipos de vieses. É descrito como a forma mais significativa de má conduta científica (Al-Marzouki et al. 2005). O viés de relato foi reconhecido há centenas de anos, desde o século XVII (Dickersin & Chambers, 2010) e, desde então, várias definições de viés de relato foram propostas:
O Dicionário de Epidemiologia define viés de relato como “a revelação ou supressão seletiva de informações (por exemplo, sobre histórico médico passado, tabagismo, experiências sexuais) ou de resultados de estudos”.
O Cochrane Handbook afirma que “este viés surge quando a divulgação dos resultados da pesquisa é influenciada pela natureza e direção dos resultados”.
A Biblioteca James Lind afirma que “o relato tendencioso da pesquisa ocorre quando a direção ou significância estatística dos resultados influencia se a pesquisa é relatada e como isto é feito”.
Nossa definição de viés de relato é a distorção das informações apresentadas no estudo devido à divulgação seletiva ou retenção de informações pelas partes envolvidas em relação ao tópico selecionado para o estudo e o desenho, condução, análise ou disseminação dos métodos de estudo, resultados ou ambos.
Pesquisadores já descreveram sete tipos de vieses de relato, incluindo viés de publicação, viés de intervalo de tempo, viés de publicação múltipla (duplicidade), viés de localização, viés de citação, viés de idioma e viés de relato de desfecho (Higgins & Green. 2011). A Figura 1 ilustra os momentos do estudo em que os vieses de relato podem ocorrer e fornece vários exemplos.
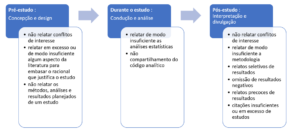
Figura 1. Adaptado de Richards GR, Onakpoya IJ. Catálogo de vieses: Vieses de relato. Em: Catalog Of Bias 2019: www.catalogueofbiases.org /reportingbiases
Exemplos
Uma revisão narrativa conduzida por McGauran et al. (2010) descobriu que os vieses de relato são comuns e amplamente disseminados na literatura médica. Foram identificados vieses de relato em 50 tipos de intervenções farmacológicas, cirúrgicas, diagnósticas e preventivas, que incluíam a omissão de dados do estudo ou a tentativa ativa dos patrocinadores do estudo de suprimir a publicação dos resultados quando esses não lhe eram convenientes.
A revisão sistemática de Jones et al. (2015) comparou os resultados de ensaios clínicos randomizados especificados em protocolos registrados com os artigos subsequentes publicados em periódicos e revisados por pares. Houve discrepâncias entre resultados predefinidos e os que foram relatados em um terço dos estudos. Treze por cento dos estudos introduziram novo resultado nos artigos publicados em comparação com aqueles registrados nos protocolos.
No estudo de coorte de revisões sistemáticas da Cochrane, Saini et al. (2014) descobriram que 86% das revisões não relataram dados sobre o principal resultado prejudicial de interesse.
Outro estudo de coorte encontrou inconsistências significativas no relato de eventos adversos ao comparar bancos de dados de financiadores dos estudos com os protocolos de registro dos mesmos estudos (Scharf & Colevas, 2006). Em 14 dos 22 estudos incluídos, o número de eventos adversos no banco de dados do patrocinador diferiu dos artigos publicados em 20% ou mais.
Quando informações complementares mais detalhadas sobre as intervenções foram analisadas nos ensaios clínicos de oseltamivir, mais da metade (55%) das avaliações anteriores de risco de viés foram reclassificadas de ‘baixo’ risco de viés para ‘alto’ (Jefferson et al. 2014).
Impacto
Ensaios clínicos e revisões sistemáticas são usados por médicos, gestores e formuladores de políticas públicas para desenvolver diretrizes baseadas em evidências e tomar decisões sobre o tratamento ou a prevenção de agravos de saúde. Quando a base de evidências disponível para médicos, formuladores de políticas ou pacientes é incompleta ou distorcida, as decisões e recomendações de saúde são feitas com base em evidências enviesadas.
O casodo Vioxx (rofecoxib), inibidor de Cox-2 prescrito para dor na osteoartrite, fornece exemplo importante de subnotificação e relato incorreto de dados que levaram a danos significativos ao paciente. A primeira análise de segurança do maior estudo de rofecoxib encontrou risco 79% maior de morte ou evento cardiovascular grave em um grupo de tratamento em comparação com o outro (Krumholz et al., 2007). Esta informação não foi divulgada pelo fabricante (Merck), e o ensaio continuou. O risco cardiovascular associado ao rofecoxib foi obscurecido de várias maneiras.
Vários conflitos de interesse significativos entre os membros do conselho da Merck não foram divulgados e não se tornaram públicos enquanto o estudo estava em andamento ou quando o estudo foi publicado (Krumholz et al., 2007). A Merck agora enfrenta ações legais de quase 30.000 pessoas que sofreram eventos cardiovasculares adversos enquanto tomavam rofecoxib.
Se os benefícios forem superestimados e os danos subestimados, médicos, pacientes e o público terão falsa sensação de segurança sobre a segurança dos tratamentos. Isso resulta em sofrimento e morte desnecessários (Cowley et al. 1993), perpetua o desperdício de pesquisa e desorienta pesquisas futuras (Glasziou & Chalmers, 2018).
Medidas preventivas
A transparência é a ação mais importante para garantir a confiabilidade das pesquisas em saúde.
Pré-estudo: os resultados de estudos prospectivamente registrados têm probabilidade significativamente maior de serem publicados do que dos estudos não registrados (OR ajustado 4,53, IC 95% 1,12-18,34; Chan et al., 2017). O registro prospectivo de todos os ensaios clínicos deve ser exigido e incentivado para outros desenhos de estudo por editores de periódicos, reguladores, comitês de ética em pesquisa, financiadores e patrocinadores.
Durante o estudo: práticas de open Science, como disponibilizar publicamente dados não identificados e código analítico por meio de plataformas como o GitHub ou o Open Science Framework ajudam na reprodutibilidade, evitam a duplicação, reduzem o desperdício, aceleram a inovação, identificam erros e evitam vieses de relatos.
Pós-estudo: diretrizes de relatos como o CONSORT podem ajudar a orientar os pesquisadores a melhorar seus relatos de estudos randomizados e evitar omissão voluntária ou involuntária de dados relevantes referentes ao estudo (Moher et al., 2010).
Outras listas de verificação e ferramentas foram desenvolvidas para avaliar o risco de vieses de relatos em estudos, incluindo a ferramenta Cochrane Risk of Bias, GRADE e ORBIT-II (Page et al., 2018).
Link para o original: https://catalogofbias.org/biases/reporting-biases/
Deve ser citado como: Catalogue of Bias. Richards GC, Onakpoya IJ. Reporting biases. In: Catalog Of Bias 2019: www.catalogueofbiases.org/reportingbiases
Fontes
Al-Marzouki et al. The effect of scientific misconduct on the results of clinical trials: a Delphi survey. Contemp Clin Trials. 2005. 26: 331-337.
Dickersin & Chalmers. Recognising, investigating and dealing with incomplete and biased reporting of clinical research: from Francis Bacon to the World Health Organisation. JLL Bulletin: Commentaries on the history of treatment evaluation. 2010.
Higgins & Green. Definitions of some types of reporting biases. Cochrane Handbook for Systematic Reviews of Interventions, v5.1.0. 2011.
McGauran et al. Reporting bias in medical research – a narrative review. Trials 2010. 11:37.
Jones et al. Comparison of registered and published outcomes in randomized controlled trials: a systematic review. BMC Med. 2015; 13:282.
Saini et al. Selective reporting bias of harm outcomes within studies: findings from a cohort of systematic reviews. BMJ 2014; 349
Scharf & Colevas. Adverse event reporting in publications compared with sponsor database for cancer clinical trials. J Clin Oncol 2006. 24:24 pp 3933-8.
Jefferson et al. Risk of bias in industry-funded oseltamivir trials: comparison of core reports versus full clinical study reports. BMJ Open 2014;4:e005253.
Krumholz et al. What have we learnt from Vioxx? BMJ, 2007. 334(7585): 120-123
Cowley et al. The effect of lorcainide on arrhythmias and survival in patients with acute myocardial infarction: an example of publication bias. Int J Cardiol 1993. 1;40(2): 161-6.
Glasziou & Chalmers. Research waste is still a scandal. The BMJ 2018; 363:k4645.
Chan et al. Association of trial registration with reporting of primary outcomes in protocols and publications. JAMA 2017; 318:17, 1709-1711.
Moher et al. CONSORT 2010 Explanation and Elaboration: updated guidelines for reporting parallel group randomised trials. 2010. 340:c869
